不銹鋼在Nac1溶液中的“環(huán)狀”陽極極化曲線如圖3所示。
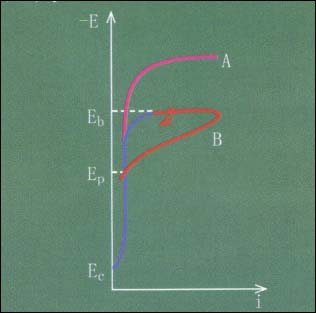
圖3 不銹鋼在Nacl溶液中的“環(huán)狀”陽極極化曲線
當(dāng)溶液中不含C1ˉ時(shí),不銹鋼的陽極極化曲線(EcA)中,穩(wěn)定鈍化電位區(qū)間較寬。
如果溶液中含C1ˉ,當(dāng)極化電位升至孔蝕電位Eb(又稱擊穿電位)時(shí),陽極溶解電流開始顯著增大,不銹鋼表面產(chǎn)生小孔。當(dāng)極化電流密度達(dá)到預(yù)定值后,電位立即以一定速度回掃(BEp),電流再次回到鈍態(tài)電流密度。此時(shí),鈍化膜己重新修復(fù)好,再次回到鈍化狀態(tài),Ep稱再鈍化電位或保護(hù)電位。
可見,氯離子對鈍化膜的破壞,只是出現(xiàn)在一定的電位范圍內(nèi)。
當(dāng)E>Eb時(shí),金屬發(fā)生孔蝕;當(dāng)Eb>E>Ep,金屬表面已有的蝕孔繼續(xù)生長,但不再產(chǎn)生新的蝕孔;當(dāng)E<Ep,金屬處于鈍態(tài)。以此可以衡量不銹鋼鈍化狀態(tài)的穩(wěn)定性以及耐各種介質(zhì)侵蝕的性能。
但必須注意的是,用動(dòng)電位法測量時(shí),Ep值與掃描速度有關(guān),而Eb值與回掃的電流密度值有關(guān)。所以,只有控制在相同的測試條件下,方可用此法相對比較不銹鋼的耐孔蝕能力和再鈍化能力。
氯離子破壞鈍化的機(jī)理
成相膜論者認(rèn)為,由于氯離子半徑小,穿透力強(qiáng),它最容易透過。膜申極小的孔隙與基體金屬相互作用形成可溶性化合物,導(dǎo)致局部腐蝕發(fā)生。
吸附論者認(rèn)為,C1ˉ具有很強(qiáng)的可被金屬吸附的能力,而且溶液中的C1ˉ、溶解O2或OHˉ在Fe、Cr等金屬表面上存在著競爭吸附,原來被吸附的02可被C1ˉ排代,從而使原來耐蝕性好的鈍化膜(金屬—氧—羥水合絡(luò)合物)成為可溶性的絡(luò)合物(金屬—氧—羥—氯絡(luò)合物),使膜被破壞造成局部腐蝕。
過鈍化及其腐蝕
實(shí)踐證明,金屬獲得并維持鈍態(tài)可降低腐蝕。但利用鈍性時(shí),必須嚴(yán)格注意防止過鈍化引起的腐蝕。
化學(xué)鈍化中,由于強(qiáng)氧化劑介質(zhì)的作用,會(huì)使金屬進(jìn)入過鈍化區(qū),表面將形成可溶性或不穩(wěn)定的化合物,腐蝕速度重新增大。例如18—8型不銹鋼在高濃度硝酸中會(huì)形成可溶的高價(jià)鉻的化合物,發(fā)生強(qiáng)烈的過鈍化腐蝕。
陽極鈍化中,當(dāng)陽極(被保護(hù)設(shè)備)電位過高,偏離鈍化區(qū)進(jìn)入過鈍化區(qū)時(shí),同樣會(huì)出現(xiàn)過鈍化腐蝕。例如碳鋼在化肥工業(yè)的碳化生產(chǎn)液中陽極極化,當(dāng)電位升高到0.8Ⅴ以上,也同樣進(jìn)入了過鈍化區(qū),此時(shí)鐵被氧化成更高價(jià)的,可溶性化合物,使腐蝕加劇。
鈍性的利用
金屬材料的合金化
金屬材料的耐蝕性提高,往往是通過合金化途徑,若將某些易鈍化的金屬,如Ti、A1等和鈍化性較弱的金屬組成固溶體合金時(shí),可使鋼表面易形成鈍化膜,顯著提高了鋼的耐蝕性和其他性能。
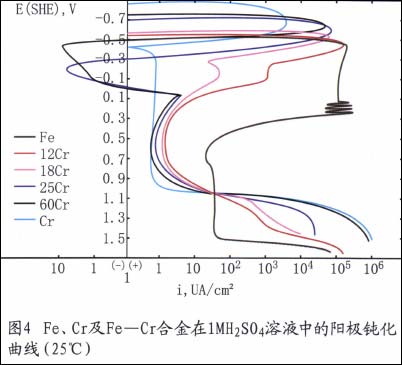
例如,鉻是不銹鋼獲得耐蝕性的最基本元素。在氧化性介質(zhì)中,鉻能使鋼表面很快生成Cr203保護(hù)膜。這種膜一旦被破壞,會(huì)很快修復(fù)。在氧化性條仵下,隨鋼中含鉻量的升高,其耐蝕性愈好。如圖4所示。
鉬也是不銹鋼中主要的合金元素,通常添加2%~3%鉬時(shí),鋼的表面形成富鉬氧化物膜。
鉬能有效地提高鋼的孔蝕電位,可抑制因氯離子侵入而產(chǎn)生的孔蝕。當(dāng)鉬和鉻配合使用時(shí),抗孔蝕效果更佳。
免責(zé)聲明:本網(wǎng)站所轉(zhuǎn)載的文字、圖片與視頻資料版權(quán)歸原創(chuàng)作者所有,如果涉及侵權(quán),請第一時(shí)間聯(lián)系本網(wǎng)刪除。
-
標(biāo)簽: 金屬應(yīng)用鈍化

官方微信
《腐蝕與防護(hù)網(wǎng)電子期刊》征訂啟事
- 投稿聯(lián)系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護(hù)網(wǎng)官方QQ群:140808414





