為便于準確理解極化作用,經(jīng)常利用電位E-電流強度I或電流密度i圖來描述。如圖5所示。
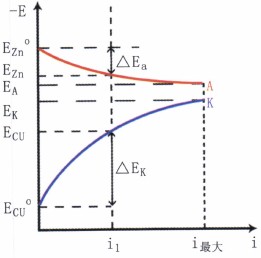
圖5極化曲線
圖中ECu°和EZn°分別為銅電極和鋅電極的開路電位。隨著電流密度的增加,陽極電位沿曲線EZn° A向正方向移動,而陰極電位沿曲線ECu°K向負方向移動。把表示電極電位與極化電流密度之間的關(guān)系曲線稱為極化曲線。圖5中EZn° A為陽極極化曲線;而ECu° K為陰極極化曲線。ΔEa和ΔEk分別是在電流密度為i1時的陽極極化值和陰極極化值。
從極化曲線的形狀得知,電極極化的大小可判斷電極反應(yīng)的難易程度。若極化曲線較陡,表明極化值較大,反應(yīng)的阻力大,過程較難進行;若極化曲線較平坦,則表明極化值較小,阻力也小,反應(yīng)容易進行。
極化產(chǎn)生的原因和類型
極化現(xiàn)象產(chǎn)生的實質(zhì)在于電子的遷移速度比電極反應(yīng)及其相關(guān)的步驟完成的速度快。進行陽極反應(yīng)時,金屬離子轉(zhuǎn)入溶液的速度落后于電于從陽極流到外電路的速度,這就使陽極上積累起過剩的正電荷,導(dǎo)致陽極電位向正方向移動;在陰極反應(yīng)中,接受電子的物質(zhì)來不及與流入陰極的電子相結(jié)合,這就使電子在陰極上積累,導(dǎo)致陰極的電位向負方向移動。
任何一個電極反應(yīng)的進行,都要經(jīng)過—系列互相連續(xù)的步驟,其中阻力最大的、進行最困難的、決定整個電極過程速度的最慢步驟稱為控制步驟,電極的極化主要是電極反應(yīng)過種中控制步驟所受阻力的反映。
極化主要分為兩類:電化學極化和濃度極化,其極化曲線的形狀如圖6所示。

圖6有極化時電極過程的極化曲線
電化學極化:如果電極反應(yīng)所需的活化能較高,因而使有電荷轉(zhuǎn)移的電化學過程速度變得最慢,成了整個電極過程的控制步驟,由此導(dǎo)致的極化稱為電化學極化又稱活化極化。濃度極化:如果反應(yīng)物從溶液相中向電極表面運動或產(chǎn)物自電極表面向溶液相內(nèi)部運動的液相傳質(zhì)步驟很慢以至于成為整個電極反應(yīng)過程的控制步驟,與此相應(yīng)的極化稱為濃度極化,對于腐蝕來講,其中的擴散過程最為重要。
腐蝕金屬電極及其極化行為
腐蝕體系與腐蝕電位
金屬發(fā)生腐蝕時,在金屬/溶液界面上至少有兩個不同的電極過程同時在進行,如圖7所示。一個是金屬電極反應(yīng),另一個溶液中去極化劑在金屬表面進行的電極反應(yīng)。當體系穩(wěn)定時:
一個是按金屬電極過程的陽極反應(yīng)方向:
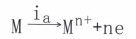 (主a為陽極電流密度)
(主a為陽極電流密度)一個是按去極化劑電極過程的陰極反應(yīng)方向
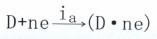 (主k為陰極電流密度)
(主k為陰極電流密度)并以相等的反應(yīng)速度在進行,即ia=ik+ic
ic為腐蝕電流密度。
此時,由于這兩個電極過程的平衡電位Ee,M和Ee,D不相等,它們彼此互相極化,都將偏離各自的平衡電位而相向極化到一個共同的非平衡電位Ec,稱之為腐蝕電位。其數(shù)值是在這兩個反應(yīng)的平衡電位之間,所以也稱為混合電位,即: Ee,M<EC<Ee,D
可見,腐蝕體系是一個共軛體系,是非衡體系所建立起來的穩(wěn)定電位稱之為腐蝕電位。腐蝕過程中的陰、陽極反應(yīng)為相互耦合的共軛反應(yīng),其中的陽極反應(yīng)是金屬材料的溶解,結(jié)果導(dǎo)致金屬的腐蝕破壞。
腐蝕極化圖及其應(yīng)用
研究金屬腐蝕問題時,經(jīng)常利用圖解法。
將陰極和陽極極化曲線繪制在同一個電位—電流坐標圖上,再稍加簡化得出的圖稱腐蝕極化圖亦稱伊 文思極化圖,如圖8a所示。
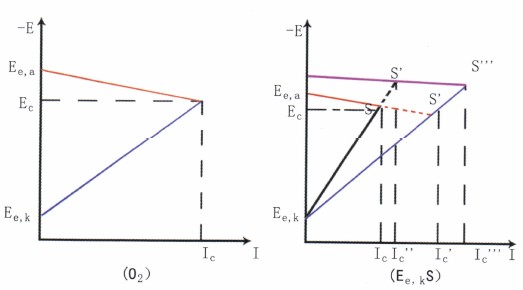
圖8陰極控制的腐蝕過程
極化圖的應(yīng)用主要有以下幾點。(1)判定腐蝕過程的主要控制因素
①陰極控制的腐蝕過程。如圖8b所示,這類腐蝕陰極極化曲線很陡,陽極極化曲線平坦,腐蝕電位EC,接近陽極的起始電位Ee,a,由于是陰極反應(yīng)困難而控制腐蝕,使任何促進陰極反應(yīng)的因素,都會使腐蝕顯著增大。
碳鋼在海水中的腐蝕屬于此類情況。流動能促進O2去極化劑的還原反應(yīng),故陰極極化曲線Ee,kS′比Ee,kS平坦,從而導(dǎo)致腐蝕速度明顯加大(Ic′>Ic),所以流動海水中的腐蝕要比靜態(tài)中的嚴重得多。
若在溶液中加入硫化物,因為S2-不但使陽極反應(yīng)受到催化,而且還使溶液中Fe2+濃度大大降低:導(dǎo)致陽極反應(yīng)的起始電位更負,使整個陽極極化曲線負移,這也促進腐蝕電流顯著加大(Ic′′′> Ic′′)。
免責聲明:本網(wǎng)站所轉(zhuǎn)載的文字、圖片與視頻資料版權(quán)歸原創(chuàng)作者所有,如果涉及侵權(quán),請第一時間聯(lián)系本網(wǎng)刪除。
-
標簽: 腐蝕金屬極化作用
相關(guān)文章
無相關(guān)信息

官方微信
《腐蝕與防護網(wǎng)電子期刊》征訂啟事
- 投稿聯(lián)系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網(wǎng)官方QQ群:140808414
文章推薦
點擊排行
PPT新聞
“海洋金屬”——鈦合金在艦船的
點擊數(shù):8135
腐蝕與“海上絲綢之路”
點擊數(shù):6475





