摘要
采用分子自組裝技術在Cu表面制備緩蝕膜。通過電化學方法分別測試2-氨基苯并噻唑 (ABT),苯并三氮唑 (BTA) 單獨存在和復配后的性能,考察了復配緩蝕劑的配比和濃度兩個因素的影響。通過動力學,并結合場發射掃描電子顯微鏡 (SEM)、原子力顯微鏡 (AFM)、拉曼光譜 (RAM) 和光學接觸角 (CA) 分析,探討了緩蝕機理;通過計算協同參數S來衡量ABT和BTA協同效應的強弱。結果表明,當總濃度為20 mmol/L,各自比例占50%時,緩蝕率可達96.34%。兩種緩蝕劑同時存在物理吸附 (分子間作用力) 和化學吸附 (孤對電子和金屬空軌道結合形成配位化合物),且在銅片表面形成致密且有序的保護膜。同時,經ABT-BTA組裝的Cu表面的接觸角較大,表面粗糙度較小;ABT比例為50%時,S=25.32,在此條件下協同作用較強。
關鍵詞: Cu; 2-氨基苯并噻唑; 苯并三氮唑; 自組裝膜; 協同效應; 緩蝕
Cu及其合金具有較優良的導電性、導熱性和耐蝕性[1-4]。因此,Cu及銅合金被廣泛應用于海洋工業。然而,海水中鹽的存在增強了Cu及其合金的導電性,極易造成電化學腐蝕。研究人員采用了多種方法,如添加緩蝕劑[5,6],自組裝膜技術[7],涂層[8]和表面鈍化[9]等,對Cu及其合金進行腐蝕防護。
有機緩蝕劑由于其成本低,添加量少等特點,而被廣泛應用[10]。尤其是含有N、P、S、O的雜環化合物,具備多個活性吸附位點,更容易吸附于金屬表面,形成絡合物[11-13],阻止腐蝕加劇。BTA是Cu及其合金的優良緩蝕劑[14,15],其三唑環上的N=N結構可以與Cu表面空軌道結合,形成配位,然而單一使用時濃度較大且緩蝕效果不理想。ABT價格低廉,而且其噻唑環上的N原子和氨基上的N原子都含有孤對電子,可以與Cu表面空軌道結合[13,16],苯環的存在一定程度上可以抵御介質進入金屬表面。因此,采用ABT與BTA復配。
本文通過電化學方法和表面分析技術分別測試單一緩蝕劑和復配緩蝕劑的性能,并采用動力學分析了緩蝕機理。使用協同參數S衡量協同效應的強弱。考慮到緩蝕劑分子多通過自組裝在金屬表面上發生吸附,因此本文采用此方法開展相關研究。
1 實驗方法
1.1 實驗步驟
以紫銅 (25 mm×25 mm×3 mm) 為實驗材料,依次用800#,1000#和2000#金相砂紙打磨,去離子水清洗,乙醇脫脂。室溫條件下,在Cu表面分別自組裝2-氨基苯并噻唑 (ABT),苯并三氮唑 (BTA),以及ABT與BTA的混合物10 h。分別考察混合緩蝕劑的比例和濃度兩個變量對緩蝕性能的影響。ABT和BTA的結構如圖1所示。本文中ABT和BTA的混合物用ABT-BTA表示。
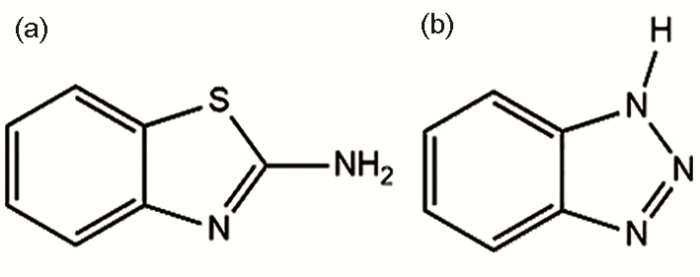
圖1 ABT和BTA有機物分子結構
1.2 電化學測試
電化學測量采用PGSTAT302N電化學工作站完成。在室溫 (25 ℃) 下三電極體系中進行。紫銅樣品作為工作電極,有效接觸面積為1 cm×1 cm,Pt為對電極,飽和甘汞電極作為參比電極。實驗試劑為3.5% (質量分數) NaCl溶液。所有阻抗實驗均在頻率范圍為105~10-2 Hz進行,振幅10 mV。極化曲線測量從低電位掃描至高電位,掃速為0.5 mV/s。
1.3 表面分析
分別采用S-4800型場發射掃描電鏡 (SEM),XE-70原子力顯微鏡 (AFM) 進行表面形貌觀察,采用Datephysics OCA 15光學接觸角測量儀進行接觸角測試,采用LabRAM HR Evolution Raman光譜儀測試樣品在銅片表面是否發生吸附。
2 結果與討論
2.1 動電位極化曲線分析
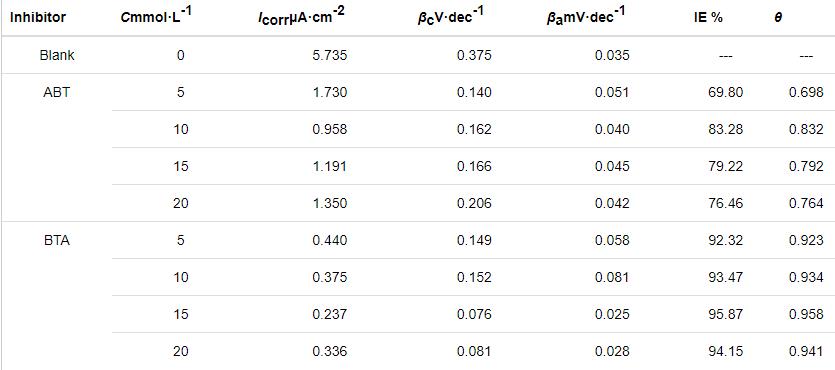
為了研究單一緩蝕劑對Cu表面的影響,采用動電位極化曲線測量,如圖2所示。與裸銅相比,經ABT組裝的銅片的自腐蝕電位均負移,當濃度達到10 mmol/L時,緩蝕率為83.28%,緩蝕性能較好。隨著緩蝕劑濃度繼續增大,緩蝕劑分子數目增多導致分子團聚現象,緩蝕率降低。銅片經不同濃度的BTA修飾后,腐蝕電流密度均降低,表明在此濃度區間內,BTA對銅片腐蝕有抑制作用;當濃度為15 mmol/L時,緩蝕率達到了95.87%。對應的電化學參數如表1所示。其中,Icorr為腐蝕電流密度,βa為陽極Tafel斜率,βc為陰極Tafel斜率,η代表緩蝕效率,由以下方程計算得出:
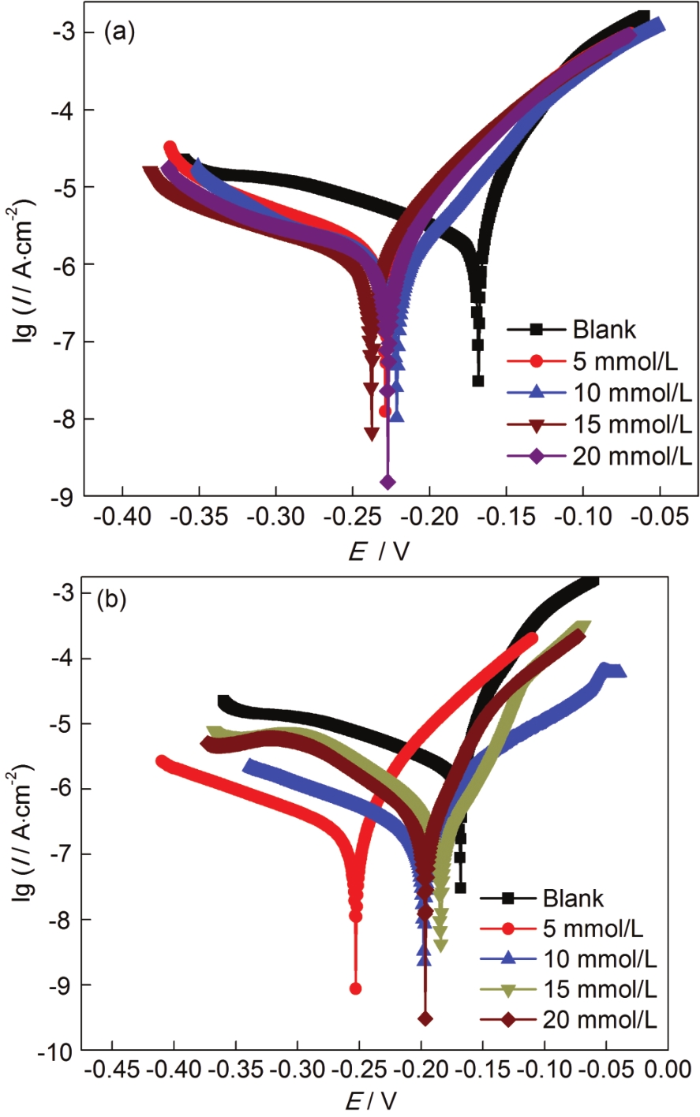
圖2 Cu電極分別經不同濃度ABT和BTA組裝后在3.5%NaCl溶液中的動電位極化曲線
表1 Cu電極分別經不同濃度ABT和BTA組裝后的極化曲線擬合參數
其中,Icorr(blank) 和Icorr(inh) 分別表示無緩蝕劑和添加緩蝕劑時測量的動電位極化曲線上的腐蝕電流密度。
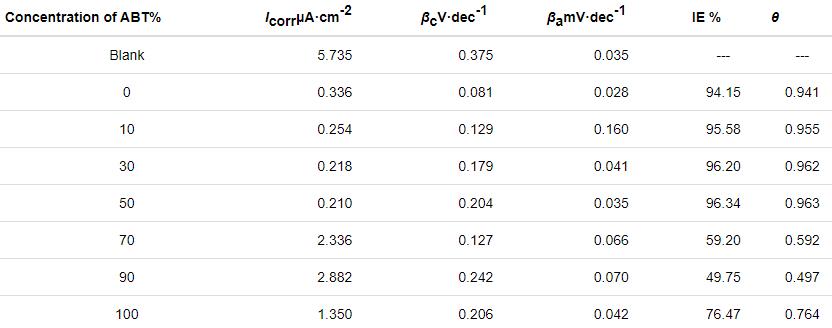
ABT和BTA總濃度為20 mmol/L,ABT濃度不同時,以ABT-BTA為混合緩蝕劑的極化曲線如圖3所示。隨著ABT濃度的增大,自腐蝕電流值先減小后增大。當ABT濃度達到50%時,自腐蝕電流最小,緩蝕效率最大,達到96.34%,緩蝕性能優于單一ABT或BTA,表明兩者之間存在協同效應,相互促進吸附。電化學極化曲線參數如表2所示。
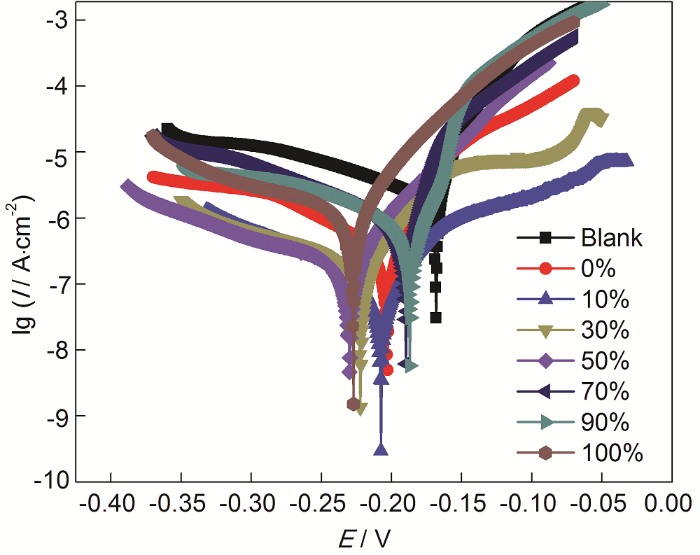
圖3 在ABT和BTA總濃度為20 mmol/L而ABT濃度不同時,Cu電極在3.5%NaCl溶液中的動電位極化曲線
表2 對圖3中極化曲線擬合所得電化學參數
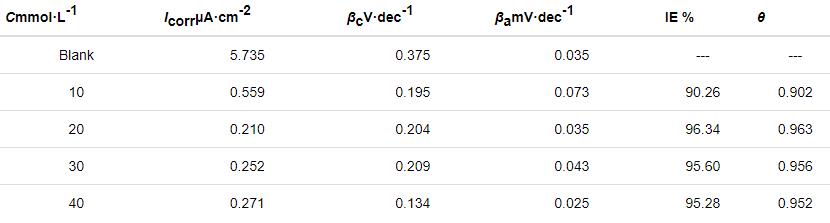
當ABT濃度為50%時而ABT-BTA總濃度不同時,Cu電極在3.5%NaCl溶液中的動電位極化曲線如圖4所示。隨著濃度的升高,自腐蝕電流值先下降后上升。當混合物濃度為20 mmol/L時,腐蝕電流密度數值相較裸銅下降兩個數量級,緩蝕率達到96.34%。擬合參數如表3所示。
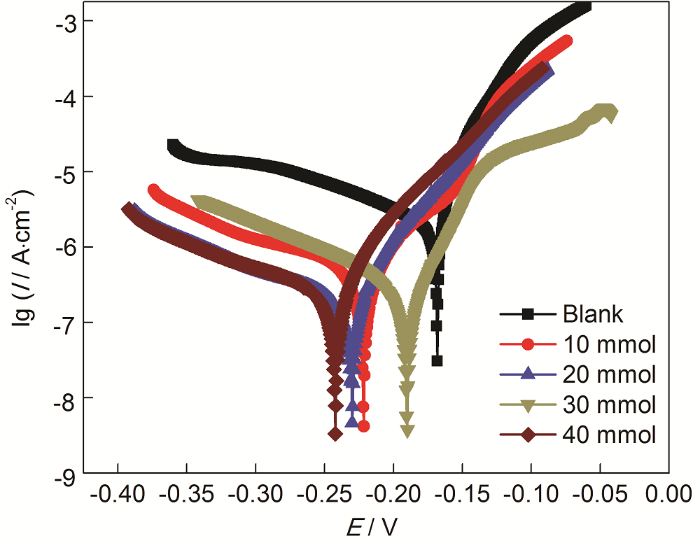
圖4 在ABT濃度為50%時而ABT-BTA總濃度不同的自組裝條件下,Cu電極在3.5%NaCl溶液中的動電位極化曲線
表3 對圖4中極化曲線擬合所得電化學參數
Cu在3.5%NaCl溶液中存在如下電化學反應:
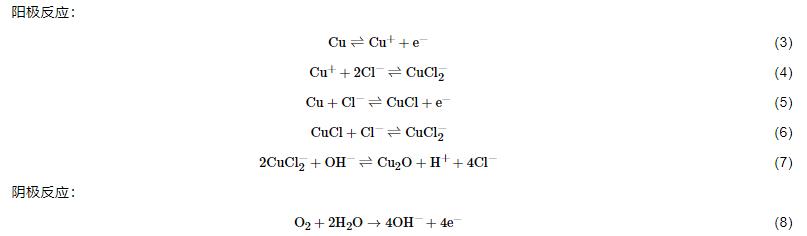
式 (3) 和 (4) 為銅片在陽極發生氧化反應的兩種情況[17,18]。
2.2 電化學阻抗分析
在開路電位 (OCP) 穩定狀態下,經總濃度為20 mmol/L而ABT濃度不同條件下自組裝后,Cu的Nyquist圖如圖5所示。可以看出,在中高頻區域,阻抗圖都近似為半圓形;隨著ABT濃度的增加,容抗弧的直徑先增大后減小。當ABT濃度為50%時,容抗弧直徑最大,緩蝕性能較好。當ABT濃度分別為70%和90%時,容抗弧直徑均小于單獨使用緩蝕劑所測得的值,這是由于隨著ABT含量的增加,空間位阻增大,對體系中BTA的吸附起阻礙作用。擬合參數如表4所示。
圖5 經總濃度為20 mmol/L而ABT濃度不同條件下自組裝后,Cu電極在3.5%NaCl溶液中的Nyquist圖
表4 對圖5中阻抗譜擬合所得等效電路各元件參數
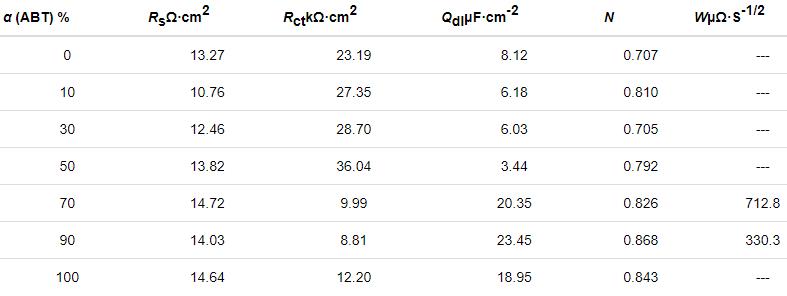
經ABT濃度為50%而ABT-BTA總濃度不同條件下自組裝后,Cu電極的Nyquist圖如圖6所示。隨著濃度的增加,容抗弧直徑先增大后減小。當濃度為20 mmol/L時,容抗弧的直徑最大。抑制效果最好。結果與動電位極化曲線測量結果相一致。擬合參數如表5所示。
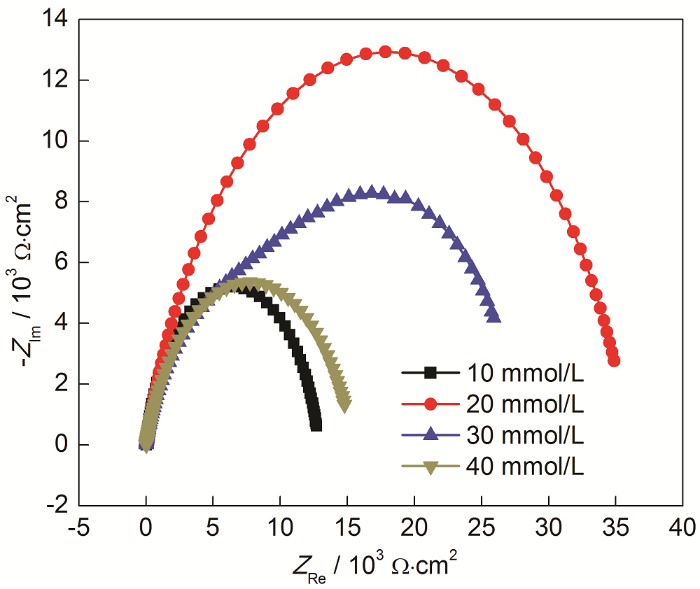
圖6 經ABT濃度為50%而ABT-BTA總濃度不同條件下自組裝后,Cu電極在3.5%NaCl溶液中的Nyquist圖
表5 對圖6中阻抗譜擬合所得等效電路各元件參數
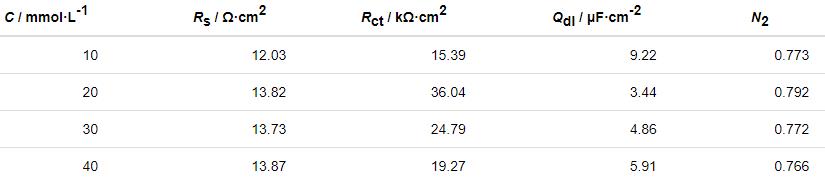
圖7為不同阻抗譜的等效電路圖。其中,Rs為溶液電阻;Qdl為雙層電容;Rct表示電荷轉移電阻;W為Warburg阻抗。
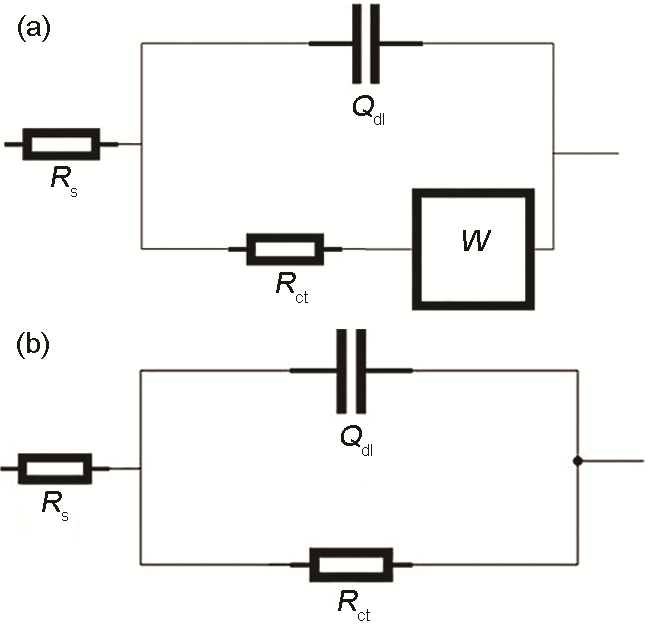
圖7 表面自組裝不同緩蝕劑的Cu電極在3.5%NaCl溶液中的等效電路圖
2.3 動力學分析
分別對ABT和BTA進行動力學分析,將極化曲線測得的覆蓋度θ代入等溫吸附方程[5,19]:
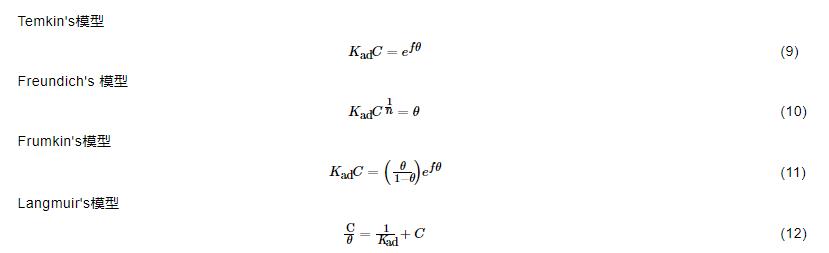
式中,Kad是吸附等溫常數;C是緩蝕劑濃度;f是分子間作用常數。通過對兩種緩蝕劑進行等溫方程擬合可以得到C/θvs C的直線,并且從圖8中可以看到兩條直線的斜率和線性相關系數都近似等于1,表明兩種緩蝕劑均遵循Langmuir吸附等溫方程[20,21]吸附于金屬表面。吸附自由能△G0ad計算公式為[5,6]:
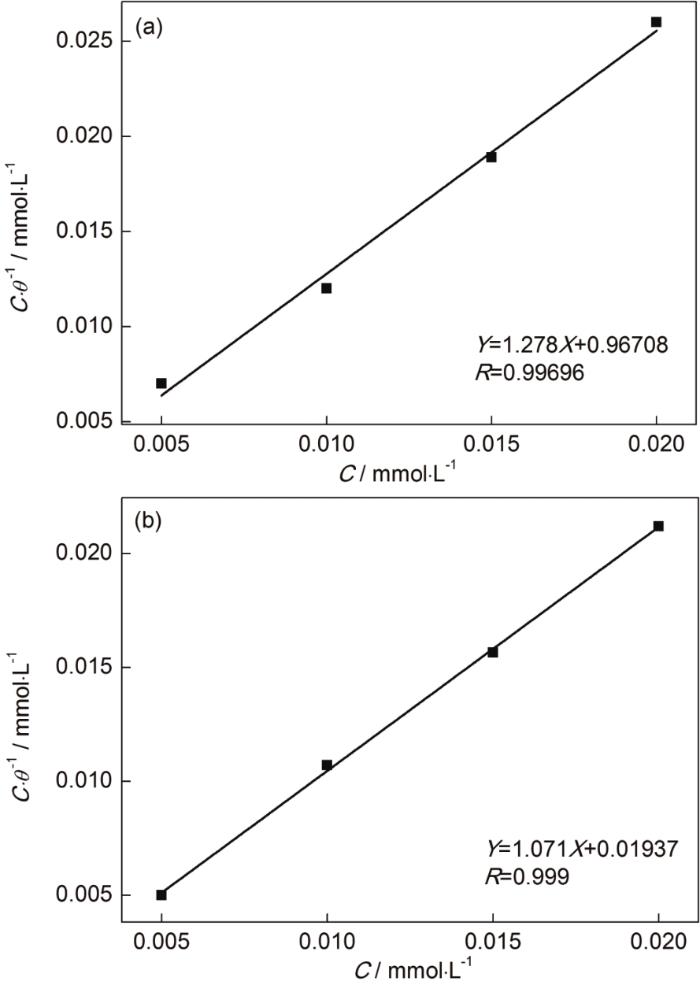
圖8 不同濃度的ABT和BTA在Cu表面的Langmuir吸附等溫曲線
![]()
式中,R是理想氣體常數 (8.314 J·mol-1·K-1),T是熱力學溫度,17.13是1 L溶液中乙醇的物質的量。通常認為,△G0ad在約-20 kJ/mol時,緩蝕劑分子通過靜電作用吸附在金屬表面,屬于物理吸附;△G0ad在約-40 kJ/mol時,緩蝕劑分子通過孤對電子和金屬空軌道結合形成配位化合物的方式吸附于金屬表面,屬于化學吸附。計算得到ABT的△G0ad值為-24.248 kJ/mol,BTA的△G0ad值為-33.941 kJ/mol。-40 kJ/mol<-33.941 kJ/mol<-24.248 kJ/mol<-20 kJ/mol,說明兩種緩蝕劑同時存在物理吸附和化學吸附。
2.4 SEM觀察結果
圖9為分別經ABT,BTA和ABT-BTA組裝的銅片在NaCl溶液中腐蝕后的SEM像。可知,ABT單獨存在時,銅片表面存在腐蝕產物裂痕,并伴有腐蝕坑;BTA單獨存在時,由于銅片在預處理過程中被金相砂紙磨損,表面有劃痕,存在輕微的腐蝕坑;ABT-BTA共同存在時,在銅片表面形成了致密且有序的保護膜,無明顯腐蝕現象,說明兩者之間存在協同作用,具有良好的緩蝕性能。

圖9 銅片分別經ABT,BTA和ABT-BTA組裝后在3.5%NaCl溶液中腐蝕后的SEM像

圖10 裸銅,分別經ABT,BTA和ABT-BTA 組裝后于Cu表面測得的接觸角
2.5 OCA測量
使用光學接觸角測量儀測定不同緩蝕劑在Cu表面的接觸角。可知,裸銅的接觸角為52.51?,ABT處理后為78.68?,BTA處理后為61.07?,ABT-BTA處理后為79.48?。可以看出,經ABT-BTA組裝的Cu表面的接觸角最大,表明兩種緩蝕劑具有良好的協同作用,此結果與SEM觀察結果一致。
2.6 Raman光譜分析
圖11分別為銅片經BTA,ABT-BTA和ABT組裝后測得的Raman光譜圖。在經BTA組裝的Cu表面,790 cm-1處為苯環呼吸的譜峰,BTA的抑制機制是三唑環上氮原子上的孤電子對與Cu原子通過配位作用發生吸附,形成銅絡合物[22],即Cu+BTA?Cu(I)BTA;1041 cm-1的譜峰標志著Cu(I) BTA的形成;1149 cm-1處為N—H面內彎曲振動譜峰;1393 cm-1處的譜峰代表三唑環伸展;1572 cm-1處為苯環伸展譜峰[23,24]。在經ABT組裝的Cu表面,490 cm-1處譜峰波數代表C—C—C彎曲;503 cm-1表示噻唑環上的C—S鍵伸展;1249 cm-1處為苯環上H—C—C鍵彎曲;1285 cm-1處為C—N鍵伸展[25-28]。在經ABT-BTA組裝的Cu表面,由于兩種組分同時存在,峰位置發生了一定程度的偏移。788,1049,1156,1390和1577 cm-1處的峰分別對應于BTA單獨存在時的790,1041,1149,1393和1572 cm-1處;490,507,1249和1294 cm-1處的峰分別對應于ABT單獨存在時的 490,503,1249和1285 cm-1處。表明兩種緩蝕劑均組裝在Cu表面,并且彼此間互相影響。
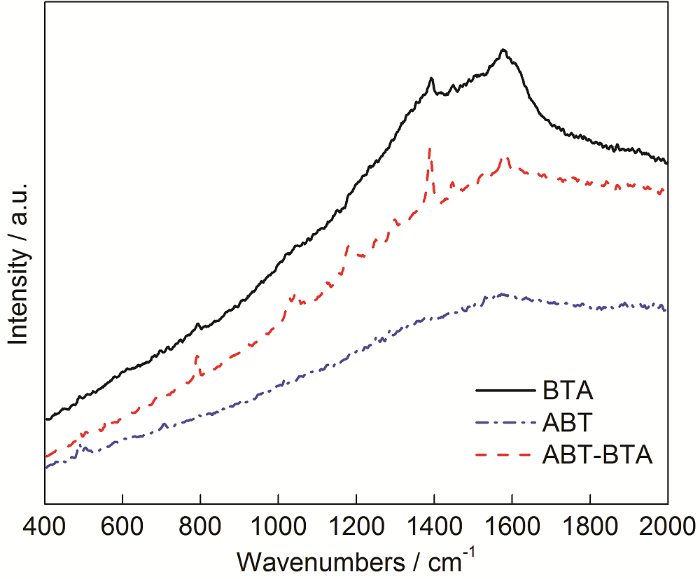
圖11 銅片表面分別經BTA,ABT和ABT-BTA組裝后的Raman光譜
2.7 AFM分析
圖12為ABT,ABT-BTA和BTA組裝銅表面的AFM像。可知,ABT在銅片表面分布不均勻,發生了團聚現象,粗糙度Ra為63.4 nm;BTA在銅片表面可以觀察到凸起很均勻地吸附到Cu表面,Ra為92 nm;經ABT-BTA混合吸附的Cu表面,整體比較平整,Ra為63 nm,說明ABT與BTA發生了良好的協同作用,彼此間相互促進空間占位。此結果與光學接觸角測量結果相一致。
圖12 ABT,ABT-BTA和BTA組裝銅表面的AFM像
2.8 緩蝕劑的協同效應
復配緩蝕劑的緩蝕性能與緩蝕劑類型、復配比例等多種因素有關,通常用協同參數S來說明協同程度的大小。對于復配使用的緩蝕劑ABT (A) 與BTA (B),協同參數S的計算公式如下[29]:
![]()
式中,ηA和ηB分別代表ABT與BTA單獨存在時的緩蝕率;ηAB代表ABT與BTA混合時的緩蝕率。若S>1,表示復配體系具有明顯的協同效應。若S≤1,表示復配體系協同作用不顯著或存在拮抗效應;S值越大,復配緩蝕劑的協同作用程度越強。可知,S50%=25.32>S30%=24.61>S10%=20.51>1>S70%=0.745>S90%=0.283,表明ABT濃度為50%時,協同作用較強;ABT濃度分別為70%和90%時,協同作用不顯著,甚至出現了拮抗作用。
3 結論
ABT和BTA復配具有良好的協同作用,ABT濃度為50%,總濃度為20 mmol/L時,對Cu在3.5%NaCl溶液中的緩蝕率達到了96.34%,緩蝕性能較好。兩種緩蝕劑同時存在物理吸附與化學吸附。復配緩蝕劑成膜比較完整,具有良好的協同效應。
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。

官方微信
《中國腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護網官方QQ群:140808414





