摘要:
通過實驗室動態(tài)模擬給水實驗,研究了氧化還原電位 (ORP) 與溶氧量、pH值、溫度、流速的關(guān)系,并提出ORP經(jīng)驗計算式。結(jié)果表明,水溶液體系ORP隨溶氧量的增大而增大,隨pH值及溫度的升高而減小,且受流速影響較小。相對于常溫ORP測量,高溫ORP信號有靈敏度高、精確性好的特點,能夠?qū)崿F(xiàn)對痕量溶氧的有效測量。在電廠實際運行中,可根據(jù)高溫在線ORP監(jiān)測結(jié)果,結(jié)合金屬電位-pH值圖判斷金屬腐蝕傾向,進而優(yōu)化給水ORP。
關(guān)鍵詞: 氧化還原電位 ; 溶氧量 ; pH值 ; 20#碳鋼 ; 高溫給水環(huán)境
氧化還原電位 (ORP) 是指由貴金屬 (Pt或Au) 指示電極、標準參比電極和被測溶液組成的測量電池的電動勢[1],是溶液氧化性或還原性相對程度的表征。目前,國內(nèi)電廠ORP測量主要應(yīng)用于水的膜處理中加氯和除氯過程的監(jiān)測,廢水處理中氧化性物質(zhì)或還原性物質(zhì)的識別。國外核電站則將其作為一種有效的水汽循環(huán)系統(tǒng)腐蝕監(jiān)測手段,用于控制沸水堆 (BWR)、壓水堆 (PWR) 一回路的加氫水化學(xué) (HWC) 和PWR二回路的加氧水化學(xué)[2,3,4]。特別是在HWC中,ORP可反映系統(tǒng)痕量O2和H2的相對含量,判斷蒸汽發(fā)生器等應(yīng)力腐蝕開裂 (SCC) 易發(fā)部位的材料腐蝕傾向。在美國、日本等國家的火電廠中,通過對凝結(jié)水出口、除氧器進出口和省煤器入口等位點水樣進行原位ORP監(jiān)測,采用PID自動控制氧化劑/還原劑的加藥量,控制凝結(jié)水-給水系統(tǒng)的腐蝕[5,6,7,8,9,10]。受限于高溫高壓在線ORP監(jiān)測技術(shù)對電極材料要求嚴格、現(xiàn)有監(jiān)測設(shè)備價格高昂等問題,該技術(shù)在國內(nèi)電廠并未取得大規(guī)模的應(yīng)用。
隨著我國火電的迅猛發(fā)展,高參數(shù)、大功率機組對汽水品質(zhì)監(jiān)督和金屬腐蝕監(jiān)控也提出了更加嚴格的要求。目前,在給水水質(zhì)監(jiān)控中需要考慮pH值、O2、氫電導(dǎo)率等眾多參數(shù),而這些參數(shù)并不能為運行人員提供直觀、全面的腐蝕控制全貌,如何通過水質(zhì)監(jiān)測指標正確反映熱力系統(tǒng)的腐蝕狀況并進行控制就顯得至關(guān)重要。高溫高壓在線ORP監(jiān)測技術(shù)具有靈敏度高、響應(yīng)迅速、無需降壓限流等特點,能夠?qū)崟r獲取水汽循環(huán)系統(tǒng)水化學(xué)和腐蝕環(huán)境原位信息,了解金屬材料服役狀態(tài)、評估設(shè)備腐蝕風(fēng)險、進一步實現(xiàn)水化學(xué)自動反饋控制,對電廠安全經(jīng)濟運行有重要意義。因此,發(fā)展火電高溫高壓水環(huán)境ORP在線監(jiān)測技術(shù)勢在必行。由于高溫高壓水的特殊環(huán)境,目前國內(nèi)關(guān)于高溫ORP原位測量開展的研究工作較少,數(shù)據(jù)積累不足,還無法做到根據(jù)監(jiān)測信號判斷發(fā)生的腐蝕類型,也無法實現(xiàn)對腐蝕過程的定量評價。本文通過實驗室模擬實驗,考查溶氧量 (DO)、pH值、流速、溫度等因素與ORP的關(guān)系,并采用電化學(xué)方法研究20#碳鋼在模擬給水環(huán)境下的腐蝕特性,分析ORP與金屬腐蝕的關(guān)系,為高溫高壓水環(huán)境ORP監(jiān)測提供理論依據(jù)。
1 實驗方法
1.1 儀器及試劑
為模擬電廠給水管路實際運行環(huán)境,在實驗室中建立動態(tài)模擬裝置進行實驗。該裝置由溶液箱、循環(huán)泵、流量計、閥門、密閉測量池、加熱器、電極和測量儀表等組成,系統(tǒng)如圖1所示。模擬裝置最高工作壓力3 MPa,最高工作溫度150 ℃。實驗主要測量儀器為CST500型電位測定記錄儀,PHS-3C型pH計,哈希9582溶氧分析儀 (精度0.5 μg),CHI660D電化學(xué)工作站。常溫電極包括雷磁218型Ag/AgCl參比電極、10 mm×10 mm×0.2 mm Pt電極。高溫高壓電極為美國CORR儀器公司生產(chǎn)的外壓平衡式Ag/AgCl參比電極和Pt對電極,材質(zhì)為C276合金。實驗用水為高純水 (18.25 MΩ·cm),因模擬水化學(xué)溶液為凈水體系,參比電極溶液均采用0.1 mol/L的KCl溶液。實驗所用主要試劑有KOH,KCl,HNO3,HCl,醌氫醌等 (分析純)。
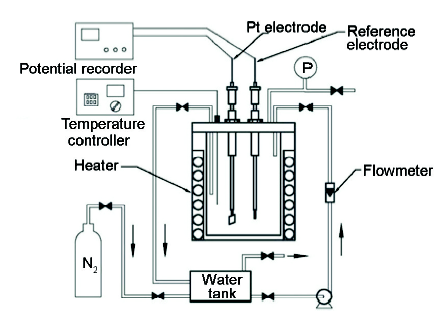
圖1 動態(tài)模擬測量試驗裝置
1.2 實驗步驟
實驗介質(zhì)為實驗室配置的模擬不同給水化學(xué)工況溶液。因氨水具有易揮發(fā)性,通氮除氧過程對溶液pH值的精確控制有一定影響,本實驗采用NaOH作為溶液pH值調(diào)節(jié)堿化劑。
ORP測量實驗在模擬裝置中進行。實驗前,先將裝置及電極清洗干凈,固定安裝兩電極系統(tǒng),并檢查裝置氣密性。電極的清洗及校正參照DL/T 1480。Pt電極依次使用硝酸 (質(zhì)量分數(shù)約50%) 和水洗凈后,利用醌氫醌標準溶液校驗電極電位[11]。然后,將配置好的體積為2 L的溶液加入溶液箱,通入N2除氧,啟泵循環(huán)后利用溶氧儀進行測定,待溶氧穩(wěn)定到期望值 (±2 μg/L) 后停止通氮。打開加熱器,加熱至設(shè)定恒溫 (±1 ℃)。實驗過程中,通過調(diào)節(jié)溶液箱出液口閥門的開度控制溶液循環(huán)流速。最后,待電位測定儀示值穩(wěn)定后,讀取記錄溶液ORP值。同一條件下進行多次重復(fù)實驗,直至3次ORP測量示值偏差的絕對值不超過5 mV,取平均值記錄。所得ORP測量值與參比電極相對于氫電極的電位值之和即為標準電位E(SHE)。本文通過下式將所測高溫電位轉(zhuǎn)換為25 ℃下標準氫電極電位[12]:
E SHE = E obs + E ref + 3 × 10 - 6 × T - T 0 3 - 0.0025 × T - T 0 2 - 0.759 × T - T 0(1)
式中,ESHE為相對氫電極的氧化還原電位,mV;Eobs為所用參比電極實測的氧化還原電位,mV;Eref為所用參比電極25 ℃下相對氫電極的電位,mV;T為所測體系溫度,℃;T0為常溫 (25 ℃)。
選用爐前系統(tǒng)典型金屬材料20#碳鋼進行腐蝕實驗研究。將暴露面積為10 mm×10 mm的20#碳鋼工作電極固定安裝于圖1所示的密閉裝置,在模擬溶液環(huán)境下腐蝕40 d,每間隔1 d測量溶液ORP和碳鋼金屬電位 (ECP)。實驗環(huán)境溫度為恒溫80 ℃,初始pH值9.0,DO100 μg/L,流速100 mL/min。
2 結(jié)果與討論
2.1 ORP影響因素考查
火電廠給水中存在多個氧化還原過程,如O2/OH-,Fe/Fe3+等,但由于給水水質(zhì)受到了嚴格控制,氫電導(dǎo)率不超過0.15 μS/cm,Fe2+含量也低于10 μg/L。其它電對的氧化還原過程相對于O2/OH-很弱,在給水中對ORP的影響較小。水的ORP測量影響因素除了DO外,主要有pH值、溫度、各電對反應(yīng)性質(zhì)和電極表面狀態(tài)等[13,14]。本文主要研究了DO、pH值、溫度和流速對ORP的影響。
2.1.1 溶解氧濃度與ORP關(guān)系 根據(jù)電廠水汽取樣分析裝置主要技術(shù)指標,選取溫度為25,35和45 ℃,流速為500 mL/min,模擬常規(guī)汽水取樣條件下ORP監(jiān)測情況。測得pH值為 (9.00±0.05) 的NaOH溶液的ORP隨DO變化如圖2所示。由圖可見,ORP隨溶解氧濃度的增大呈現(xiàn)正向增大的趨勢。結(jié)果符合O2/OH-電對的Nernst方程,O2為氧化性物質(zhì),其濃度越大ORP越正。分析圖2可知,在3個不同溫度下,ORP隨DO變化趨勢一致,在DO為0~0.5 mg/L的低濃度范圍內(nèi),ORP隨DO增大而迅速增大。當DO大于1.0 mg/L時,ORP增加幅度減小。
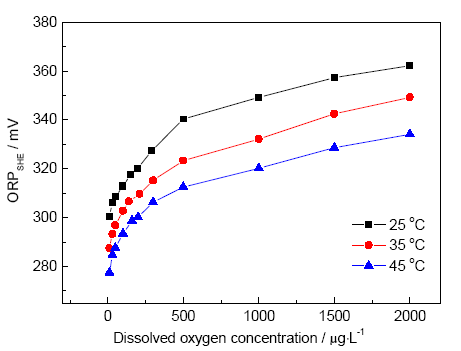
圖2 不同溫度下ORP隨DO變化曲線
圖3是ORP隨lgDO的變化曲線。對25 ℃下測量結(jié)果作線性擬合,在DO為0~0.5 mg/L的范圍內(nèi),曲線滿足ESHE=283.14+15.78 lgDO的函數(shù)關(guān)系,相關(guān)系數(shù)R2為0.9884。由此可見,在低氧濃度下,ORP與lgDO有一定的線性關(guān)系。在模擬溶液中,Na+不參與氧化還原過程,氧化還原電對O2/OH-參與的平衡反應(yīng)為:
O 2 ( g ) + 2 H 2 O ( l ) + 4 e -
其ORP的大小遵循Nernst方程,可得O2/OH-平衡電位的計算公式:
E m = E O 2 O H - θ + 2.303 RT 4 F × lg p ( O 2 ) p θ - 2.303 RT F × pH + 0.8288(3)
式中,Em為氧化還原電位,V;Eθ為標準電極電位,V;R為氣體常數(shù),8.314 J·mol-1·K-1;T為熱力學(xué)溫度,K;F為Faraday常數(shù),9.64845×104 C·mol-1; p ( O 2 ) 為氧的絕對壓力,kPa;pθ為標準大氣壓,101.325 kPa。
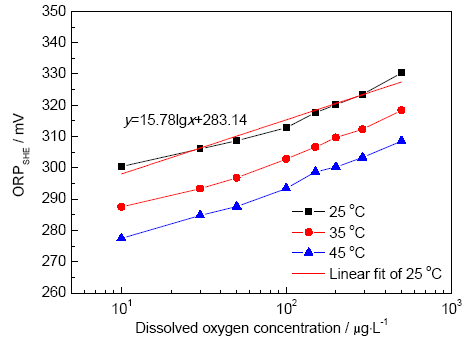
圖3 不同溫度下ORP與lgDO的關(guān)系
根據(jù)Henry定律,在稀溶液中,O2在液面上的分壓力可用下式求得:
p B = k c , b × c B(4)
式中,PB為該氣體B在液面上的分壓力,kPa;kc,b為Henry定律常數(shù);cB為氣體的物質(zhì)的量濃度,mol/m3。
25 ℃下, E O 2 O H - θ =0.4009 V,kc,B=7.8532×10-1 atm·mol-1·m3。帶入式 (4),計算得:
E O 2 O H - = 1160.6 + 14.8 lgDO - 59.2 pH(5)
將本實驗條件pH值為9.0代入式 (5),得 E O 2 O H - =627.8+14.8 lgDO。其中,DO單位為μg/L; E O 2 O H - 為電位,mV。由式 (5) 可知,在DO低于0.5 mg/L條件下,理論計算式與實驗擬合式中l(wèi)gDO項的系數(shù)大致吻合。但同一溶氧濃度下,水溶液ORP實際測量值遠低于理論計算值,如DO為100 μg/L時,ORP測量值為315 mV,計算值為657 mV,相差342 mV。黃茜等[15]認為在貴金屬電極表面上的O2/OH-反應(yīng)是一個極為緩慢的反應(yīng),即使在溶氧達到飽和的情況下,ORP也難以達到O2/OH-的平衡電位,因此,測量值遠低于計算值。Macdonald[3]研究表明,在275 ℃下模擬BWR水化學(xué)溶液中,只有在高堿性 (0.1 mol/L LiOH,pH值為10.45),[O2]≥7 mg/L的條件下,ORP測量值與計算值有良好的一致性,其它情況下都要遠遠小于理論值,差值約為300 mV。其認為一方面是由于Pt電極存在極微弱的O2的氧化污染,測得電位為Pt的氧化與O2的還原過程的混合電位。另一方面,隨著水環(huán)境pH值及O2濃度的增大,氧氣還原反應(yīng)中正逆反應(yīng)的交換電流密度增大,而Pt電極氧化過程交換電流密度極小,所以氧氣電極反應(yīng)的可逆程度增大,ORP測量值越接近平衡電位。Hoare[16]也指出,在含氧體系中Pt電極不是完全惰性的,在其表面會有極其微弱、緩慢的Pt氧化過程的發(fā)生。
模擬火電廠低壓加熱器典型溫度和水化學(xué)環(huán)境,在80,100,120 ℃下進行ORP測量,所得pH值為9.0的NaOH溶液ORP隨DO變化關(guān)系曲線如圖4所示。可以看出,高溫下ORP與溶氧濃度的對數(shù)也呈正相關(guān)的關(guān)系。表1列出了ORP與lgDO的線性擬合式與其相關(guān)系數(shù)R 2。在0~1 mg/L的溶氧濃度范圍內(nèi),ORP隨著溫度的升高而降低,且隨著溫度的升高,曲線斜率正向增大。結(jié)合式 (5) Nernst方程可知,系數(shù)RT/nF決定了ORP-lgDO的斜率,溫度越高,斜率越大,測量結(jié)果與理論預(yù)測一致。由于缺少部分高溫電極過程動力學(xué)基礎(chǔ)參數(shù),對高溫ORP進行精確計算存在一定困難。與本實驗結(jié)果類似的,Niedrach等[17]也研究得到了高溫下電位與lgDO的線性經(jīng)驗擬合式,證明DO在一定濃度范圍條件下,ORP與lgDO可用線性關(guān)系式表達。對比高溫與常溫測量結(jié)果,高溫下ORP對痕量溶氧的變化波動更大,如10~100 μg/L的DO變化,對應(yīng)常溫下ORP波動為16 mV,100 ℃下為76 mV,波動明顯。近年來,國內(nèi)電廠已多次發(fā)生因氧化皮剝落、堆積、堵塞造成爆管等事故[18],過熱器和再熱器蒸汽側(cè)氧化皮生成與剝落問題受到重視。作為可能的影響因素之一,給水和蒸汽DO應(yīng)受到更加嚴格地監(jiān)控[19,20],高溫ORP在線測量無疑為痕量DO的精確控制提供了一種可行方案。

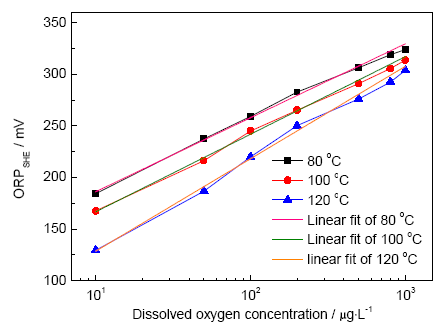
圖4 高溫條件下ORP與氧含量對數(shù)的關(guān)系
2.1.2 pH值與ORP關(guān)系 圖5為25 ℃,500 mL/min流速下,ORP隨pH值變化關(guān)系曲線。可見,ORP隨pH值的增大而逐漸減小。實驗結(jié)果符合Nernst電位理論,即氧化還原電位通常隨著H+活度的增加而增大,隨著OH-活度的增加而減小。實驗測得在25 ℃下,ORP與pH值線性關(guān)系明顯,pH值每升高一個單位,ORP降幅約為52 mV。對比式 (5),理論上pH值每增加一個單位,ORP下降59.2 mV,實驗結(jié)果與理論計算相差不大。
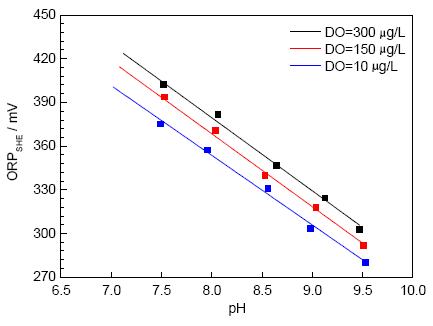
圖5 常溫下ORP與pH值的關(guān)系
實驗考查了不同溫度下ORP與pH值的變化關(guān)系,結(jié)果如圖6所示,擬合式列于表2。可以看出,ORP與pH值變化呈負相關(guān),且具有線性關(guān)系。事實上,pH值測量的本質(zhì)就為H+作用下的電位測量,一定溫度下,pH值與對應(yīng)的電位值可轉(zhuǎn)換成線性關(guān)系。對比圖5,pH值每增大1個單位,高溫下ORP的降幅遠大于常溫測量結(jié)果,其主要是因為ORP受到了溫度變化的影響。根據(jù)式 (3),ORP-pH曲線的斜率為 - 2.303 RT F ? p H ( T ) p H ( 25 °C ) ,高溫pH(T ) 對pH(25 ℃) 有下式所示的近似換算關(guān)系:
pK w ( 25 °C ) pK w ( T ) = p H ( 25 °C ) p H ( T )(6)
式中,pKw為水的離子積的負對數(shù)。計算得100 ℃下,直線理論斜率為-64 mV/pH,實驗結(jié)果為-71 mV/pH。所以,在溫度一定,DO極低的條件下,ORP可反映pH值的大小。在火電廠實際給水pH值控制中,pH值波動范圍一般不會超過0.5,但高溫下ORP對pH值波動的響應(yīng)是十分明顯的。在溶氧和pH值都波動較大的高溫環(huán)境下,可采用常溫pH值表輔助測量,以明確是否因DO波動而造成電位大幅度變化。
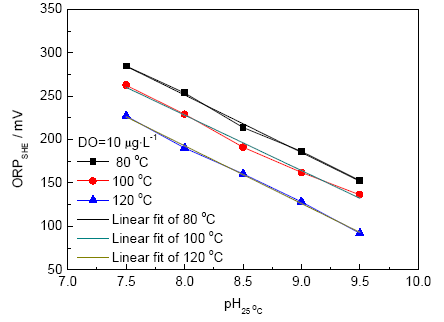
圖6 高溫下ORP與pH值的關(guān)系
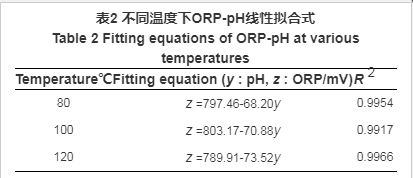
表2 不同溫度下ORP-pH線性擬合式
2.1.3 水樣流速與ORP關(guān)系 根據(jù)火電廠汽水取樣測量裝置中水樣流量一般控制在0~1000 mL/min,考察80 ℃下水樣流量對ORP的影響,結(jié)果如圖7所示。在較低的溶氧濃度下,水樣流量變化對ORP造成了輕微的波動,ORP隨水流量的增大而正向增加;在較高的溶氧濃度下,水樣流量對ORP無影響。Chen等[21]研究表明,受流體動力學(xué)條件對金屬表面電化學(xué)反應(yīng)極限電流大小的影響,金屬電極電位也隨流體條件的改變而變化,包括線性流速、雷諾數(shù)Re、流體運動粘度、流通直徑等。在極低的氧濃度條件下,由于氧的還原為擴散步驟控制的電極過程,反應(yīng)粒子自溶液本體向電極表面遷移擴散的傳質(zhì)速率取決于流體動力學(xué)條件。增加流速降低了擴散層的厚度,增大了傳質(zhì)速率,加速了金屬表面物質(zhì) (特別是氧化劑) 的電化學(xué)反應(yīng),導(dǎo)致電位的增大。流速對電位的影響是存在一定爭議的,Macdonald等[22]和Eason等[23]則認為流速對電位并沒有明顯的影響。在本實驗結(jié)果中,水流速對痕量溶氧下的水溶液ORP測量只有輕微影響。但在電廠其它ORP儀表使用環(huán)境中,如對加氯和除氯過程監(jiān)測,氧化還原反應(yīng)過程、ORP測量值與流體動力學(xué)條件的關(guān)系仍有待研究。考慮到ORP很難用計算方法加以校正,在實際測量中應(yīng)當預(yù)先選定恰當?shù)乃畼恿魉俜秶?/span>
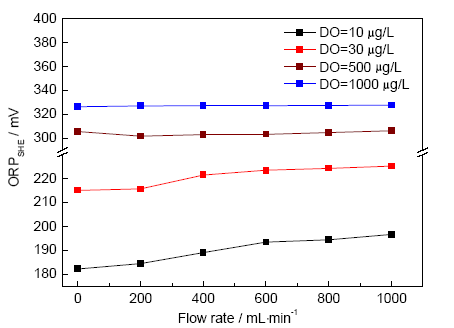
圖7 80 ℃下ORP隨水樣流量變化趨勢圖
2.1.4 溫度與ORP關(guān)系 圖8是ORP隨溫度的變化曲線。可見,ORP隨溫度的升高而逐漸降低。溫度不僅影響Nerest方程中的T,還可以影響電子轉(zhuǎn)移數(shù)和氧化劑還原劑濃度,從而也影響對數(shù)項的大小。同時,氧化還原電對O2/OH-電極反應(yīng)的標準電極電勢也隨溫度的升高而降低,且并非遵從簡單的線性關(guān)系[24]。所以,ORP的測量值難以進行溫度補償,應(yīng)避免被測體系溫度有較大的波動。
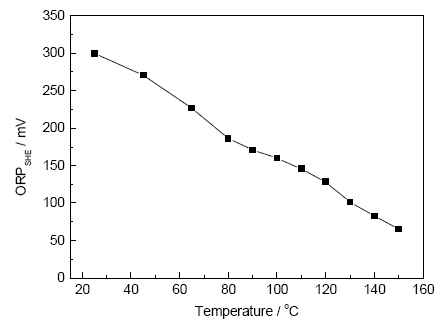
圖8 ORP與溫度的關(guān)系
2.2 ORP經(jīng)驗擬合式
根據(jù)式 (3),在一定溫度下,ORP與lgDO、pH值符合簡單的二元一次方程。由表1和2擬合式,利用Mathmatica軟件得三者關(guān)系如圖9所示。在pH值為7~9.5,溶氧濃度為0~1 mg/L的范圍內(nèi),本實驗所得ORP經(jīng)驗擬合式列于表3。
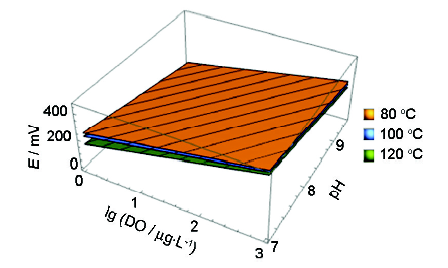
圖9 不同溫度下ORP與DO、pH值的關(guān)系
表3 不同溫度下ORP-DO-pH線性擬合式

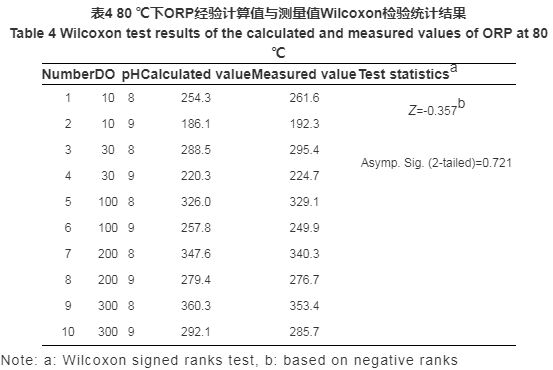
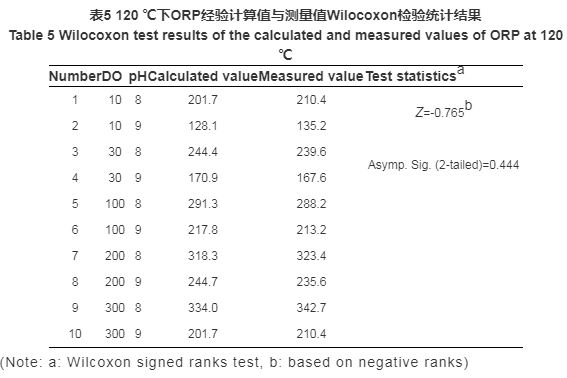
為檢驗計算式是否與實驗結(jié)果具有良好的一致性,利用SPSS軟件中Wilcoxon檢驗?zāi)K對不同條件下ORP的計算值與測量值進行兩配對樣本的非參數(shù)檢驗。此檢驗方法是在數(shù)據(jù)總體分布不甚了解的情況下,通過兩組配對樣本的分析,推斷樣本來自的兩個總體的分布是否存在顯著性差異的方法。
實驗中采用Wilcoxon檢驗?zāi)K對ORP計算值與測量值配對進行檢驗,并輸出描述性統(tǒng)計量。原假設(shè)為,ORP實驗測量值與經(jīng)驗計算值無顯著差異。秩和檢驗的結(jié)果如表4和5所示,表中給出的是Z統(tǒng)計數(shù)和近似的p值。80 ℃下,漸進顯著性 (雙側(cè)) 為0.721,說明概率p值為0.721,遠大于顯著性水平0.05,因此,原假設(shè)成立。同理,150 ℃下原假設(shè)也成立。可見ORP經(jīng)驗計算式所得結(jié)果與實驗測量值的差異并無統(tǒng)計學(xué)顯著性意義,二者具有一致性,即可根據(jù)經(jīng)驗計算式對ORP值進行計算與預(yù)測。
2.3 ORP與金屬腐蝕的關(guān)系
在金屬腐蝕過程中,電位是金屬陽極溶解過程的控制因素,溶液的pH值則是金屬腐蝕產(chǎn)物穩(wěn)定性的控制因素[25]。應(yīng)用這兩個參數(shù),可把金屬-水溶液體系中各個反應(yīng)在給定條件下的平衡關(guān)系用電位-pH平衡圖表示,進而了解金屬腐蝕的可能性和腐蝕產(chǎn)物的穩(wěn)定性,為電廠水化學(xué)工況的調(diào)節(jié)與優(yōu)化提供依據(jù)。采用熱力學(xué)軟件HSC Chemistry繪制電位-pH圖見圖10和11。平衡計算中有關(guān)離子的濃度均取10-6 mol/L,H2和O2的分壓為標準壓力 (100 kPa)。根據(jù)圖10中不同區(qū)域物質(zhì)的穩(wěn)定存在狀態(tài),可劃分為Fe的免蝕區(qū)、腐蝕區(qū)和鈍化區(qū)。由先前實驗結(jié)果可知,在80 ℃,pH值為9.0,DO>10 μg/L的條件下,給水環(huán)境ORP>170 mV,對應(yīng)圖中區(qū)域為Fe2O3的熱力學(xué)穩(wěn)定區(qū),F(xiàn)e表面上可能形成完整、致密的氧化物保護膜,從而抑制其溶解,降低腐蝕速率。而對于Cu-H2O體系,相同pH值、ORP條件下,對應(yīng)圖11中Cu2O或Cu(OH)2的熱力學(xué)穩(wěn)定區(qū),在氨存在的條件下易發(fā)生氨腐蝕,進而引發(fā)Cu的遷移與沉積。因此,在凝結(jié)水-給水系統(tǒng)含銅合金的電廠中一般采用還原性全揮發(fā)處理,加入還原劑聯(lián)胺使給水ORP<-200 mV。所以,將ORP測量值與體系pH值結(jié)合起來,利用金屬電位-pH圖能夠判斷鍋爐機組水化學(xué)調(diào)節(jié)方式是否合理。
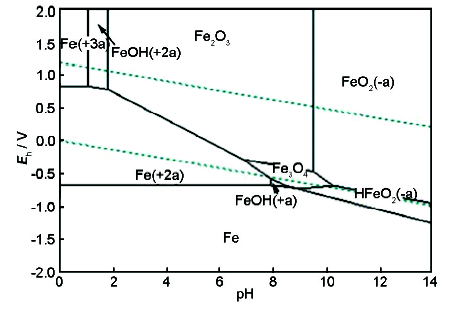
圖10 80 ℃下Fe-H2O體系電位-pH圖
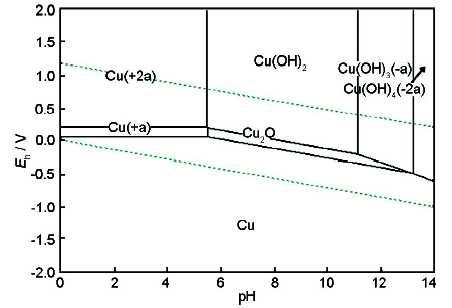
圖11 80 ℃下Cu-H2O體系電位-pH圖
腐蝕實驗測得20#碳鋼腐蝕電位與溶液ORP的關(guān)系如圖12所示。可見,金屬腐蝕電位先逐漸增大,在18 d后電位逐漸穩(wěn)定。ORP則逐漸減小,在碳鋼腐蝕電位穩(wěn)定后ORP也趨于穩(wěn)定。可見,碳鋼在高ORP、高pH值條件下逐漸發(fā)生鈍化,腐蝕生成的Fe3O4或Fe2O3覆蓋在金屬基體表面,形成氧化物保護膜,導(dǎo)致金屬電位的增大。當保護膜趨于完整時,金屬腐蝕速率降低,金屬電位也逐漸穩(wěn)定。隨著金屬的氧化和溶氧的消耗,密閉環(huán)境中溶液的ORP逐漸降低。
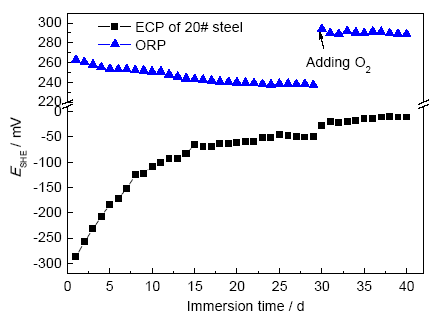
圖12 20#碳鋼腐蝕電位與溶液ORP關(guān)系圖
為探究ORP與ECP的相關(guān)性,第30 d通入O2進行擾動實驗。溶氧增大到500 μg/L后,ORP與ECP都立即正向增大,隨后ORP趨于穩(wěn)定,ECP則繼續(xù)緩慢增大。這是因為雖然腐蝕電位和ORP是以類似的方式測量,但前者反映的是發(fā)生在金屬表面上的腐蝕反應(yīng)。當金屬電極表面形成完整的鈍化膜后,金屬氧化腐蝕的速率極低,與惰性電極類似,金屬氧化膜表面提供了氧化還原電對反應(yīng)的場所。所以,此時ECP與ORP的變化是一致的,但ORP更為靈敏,且一般大于金屬腐蝕電位。
3 結(jié)論
(1) 水溶液體系ORP隨DO的增大而增大,隨pH值的增大而減小,且與二者都具有一定的線性關(guān)系。ORP隨溫度的升高而降低,但其影響機理復(fù)雜,難以進行溫度補償。ORP受溶液流速影響較小。
(2) 提出了ORP在80和120 ℃下的經(jīng)驗計算式,并采用Wilcoxon檢驗進行驗證,該計算式與實驗結(jié)果具有良好的一致性。
(3) 鈍化后的20#碳鋼的金屬電位與ORP變化趨勢一致,但無簡單的定量關(guān)系。將來仍需深入研究ORP信號與不同金屬的腐蝕過程及腐蝕機理之間的對應(yīng)關(guān)系,現(xiàn)階段可根據(jù)金屬電位-pH圖判斷金屬腐蝕傾向,通過調(diào)節(jié)DO、pH值等水化學(xué)參數(shù)優(yōu)化給水ORP。
免責(zé)聲明:本網(wǎng)站所轉(zhuǎn)載的文字、圖片與視頻資料版權(quán)歸原創(chuàng)作者所有,如果涉及侵權(quán),請第一時間聯(lián)系本網(wǎng)刪除。

官方微信
《中國腐蝕與防護網(wǎng)電子期刊》征訂啟事
- 投稿聯(lián)系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護網(wǎng)官方QQ群:140808414





